1. निम्नलिखित अभिक्रियाएँ क्या हैं ?
(i) संकलन अभिक्रिया (ii) प्रतिस्थापन अभिक्रिया (iii) एस्टरीकरण अभिक्रिया
उत्तर ⇒(i) संकलन अभिक्रिया – निकेल अथवा पैलेडियम जैसे उत्प्रेरकों की उपस्थिति में असंतृप्त हाइड्रोकार्बन, हाइड्रोजन जोड़कर संतृप्त हाइड्रोकार्बन देते हैं। उत्प्ररेक वे पदार्थ होते हैं जिनके कारण अभिक्रिया भिन्न दर से बढ़ती है। निकेल उत्प्रेरक का उपयोग करके साधारणतः वनस्पति तेलों के हाइड्रोजनीकरण में इस अभिक्रिया का उपयोग होता है। वनस्पति तेलों में साधारणतः लंबी असंतृप्त कार्बन श्रृंखलाएँ होती हैं जबकि जंतु वसा से संतृप्त-कार्बन शृंखलाएँ होती हैं।
(ii) प्रतिस्थापन अभिक्रिया – एक अभिक्रियाशील तत्त्व अपेक्षाकृत कम अभिक्रियाशील तत्त्व के लवण से तत्त्व को विस्थापित करता है, इन्हें विस्थापन अभिक्रिया कहा जाता है। जैसे—कॉपर सल्फेट के विलयन में लोहे की कील डालने पर लोहे के कील द्वारा कॉपर सल्फेट विलयन से कॉपर धातु को अलग करता है। लोहे के कील पर Cu जमा होने से यह भूरे रंग का हो जाता है और कॉपर सल्फेट के नीले रंग मलीन हो जाते हैं।
Fe(s) + CuSO4(aq.) → Feso4(aq.) + Cu (s)
(iii) एस्टरीकरण अभिक्रिया – एथेनॉइक अम्ल और एथेनॉल की अभिक्रिया किसी अम्ल उत्प्रेरक की उपस्थिति में करायी जाती है तो एस्टर का निर्माण होता है। इस अभिक्रिया को एस्टरीकरण अभिक्रिया कही जाती है।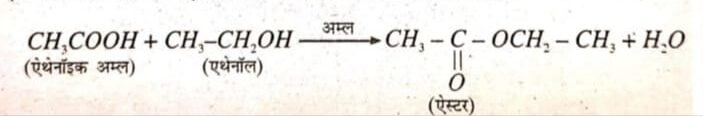
2. द्विविस्थापन अभिक्रिया से क्या समझते हैं ? एक उपयुक्त रासायनिक समीकरण देकर इसकी पुष्टि कीजिए।
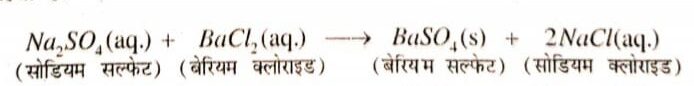
उत्तर ⇒ वे अभिक्रियाएँ जिनमें अभिकारकों के बीच आयनों का आदान-प्रदान होता है उन्हें द्विविस्थापन अभिक्रिया कहते हैं। एक परखनली में सोडियम सल्फेट का विलयन लिया जाता है। पुनः उतनी मात्रा में बेरियम क्लोराइड का विलयन लेकर उसमें मिला दिया जाता है। देखने पर एक श्वेत रंग का अवक्षेप प्राप्त होता है। इस अविलेय पदार्थ को अवक्षेप कहा जाता है।
ऐसा इसलिए होता है कि Ba2+ तथा SO4 2 की अभिक्रिया से BaSO4 का अवक्षेप का निर्माण होता है।
एक अन्य उत्पाद सोडियम क्लोराइड का भी निर्माण होता है जो विलयन में ही रहता है।
3. संतुलित रासायनिक समीकरण क्या है ? रासायनिक समीकरण को संतुलित करना क्यों आवश्यक है ?
उत्तर ⇒संतुलित रासायनिक समीकरण में रासायनिक अभिक्रिया के पहले एवं उसके पश्चात् प्रत्येक तत्त्व के परमाणुओं की संख्या समान होती है। असंतुलित (कंकाली) रासायनिक समीकरण में अभिक्रिया के पहले और बाद के उत्पादों में परमाणुओं की संख्या बराबर नहीं होती है। यह द्रव्य के अनश्वरता के सिद्धांत का पालन नहीं करता है। रासायनिक समीकरण को संतुलित रखने पर यह पता चलता है कि अभिकारकों के कितने-कितने आयतन मिलकर अभिक्रिया करते हैं और इनसे कितने आयतन उत्पाद पैदा होते हैं।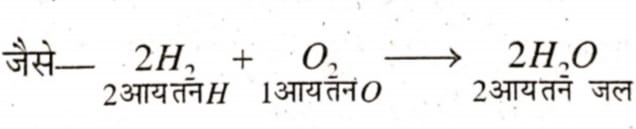 उपर्युक्त रासायनिक समीकरण संतुलित है और इससे यह पता चलता है कि 2 आयतन H और 1 आयतन 0 मिलकर 2 आयतन जल का निर्माण करता है। दूसरा, समीकरण से यह भी स्पष्ट है कि 2g H और 32g O आपस में संयोग कर 36 g जल का निर्माण करता है। लेकिन कंकाली रासायनिक समीकरण से यह सूचना अप्राप्त है। यही कारण है कि रासायनिक समीकरणों को संतुलित करना आवश्यक है।
उपर्युक्त रासायनिक समीकरण संतुलित है और इससे यह पता चलता है कि 2 आयतन H और 1 आयतन 0 मिलकर 2 आयतन जल का निर्माण करता है। दूसरा, समीकरण से यह भी स्पष्ट है कि 2g H और 32g O आपस में संयोग कर 36 g जल का निर्माण करता है। लेकिन कंकाली रासायनिक समीकरण से यह सूचना अप्राप्त है। यही कारण है कि रासायनिक समीकरणों को संतुलित करना आवश्यक है।
4. वियोजन (अपघटन) अभिक्रिया को स्वच्छ रेखाचित्र द्वारा एक क्रियाकलाप दीजिए।
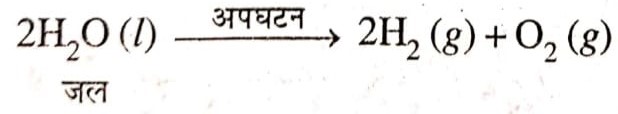
उत्तर ⇒ क्रियाकलाप – एक प्लास्टिक का मग लिया जाता है जिसकी तली में दो छिद्र करके रबड़ का डॉट लगा दिया जाता है। इन छिद्रों से होकर कार्बन इलेक्ट्रोड लगा दिया जाता है। इन इलेक्ट्रोडों को 6 वोल्ट की बैटरी से जोड़ दिया जाता है।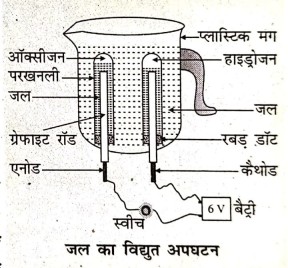 मग में इतना जल डाला जाता है कि । इलेक्ट्रोड इसमें पूर्णतः डूब जाए। जलमें तनु सल्फ्यूरिक अम्ल की कुछ बूंदे ऑक्सीजन हाइड्रोजन डाल दी जाती हैं। जल से भरी दो अंशांकित परखनलियों को इलेक्ट्रोडों पर उलट के रख दिया जाता है । अब विधुत धारा पर्बाहित कर उपकरण को थोड़ी देर छोड़ दिया जाता है । दोनों इलेक्ट्रोडों पर बुलबुले बनते हुए देखे जाते हैं। ये बुलबुले अंशांकित नली में जल का विद्युत अपघटन जल को नीचे विस्थापित कर नली में इकट्टे होते हैं।
मग में इतना जल डाला जाता है कि । इलेक्ट्रोड इसमें पूर्णतः डूब जाए। जलमें तनु सल्फ्यूरिक अम्ल की कुछ बूंदे ऑक्सीजन हाइड्रोजन डाल दी जाती हैं। जल से भरी दो अंशांकित परखनलियों को इलेक्ट्रोडों पर उलट के रख दिया जाता है । अब विधुत धारा पर्बाहित कर उपकरण को थोड़ी देर छोड़ दिया जाता है । दोनों इलेक्ट्रोडों पर बुलबुले बनते हुए देखे जाते हैं। ये बुलबुले अंशांकित नली में जल का विद्युत अपघटन जल को नीचे विस्थापित कर नली में इकट्टे होते हैं।
दोनों नलियों में इकट्ठे गैस के आयतन को देखने पर पता चलता है कि एक का आयतन दूसरे का दुगुना है। कैथोड पर एकत्रित गैस का आयतन एनोड पर एकत्रित गैस के आयतन का दुगुना है। दोनों परखनलियों को सावधानीपूर्वक हटा लिया जाता है और जलती दियासलाई की तीली से इसकी परीक्षा की जाती है। एनोड पर की गैस दियासलाई की जलती तीली को काफी तेजी से जलाता है अर्थात् यह गैस जलन का पोषण करता है। कैथोड पर की गैस जलन का पोषण नहीं करता है बल्कि यह विस्फोट के साथ जल उठता है। कैथोड पर उत्पन्न गैस हाइड्रोजन और एनोड पर उत्पन्न गैस ऑक्सीजन है।
अतः जल के अपघटन से हाइड्रोजन और ऑक्सीजन गैस निर्मित होते हैं।
5. एक क्रियाकलाप द्वारा विस्थापन अभिक्रिया को दर्शाइए।
उत्तर ⇒
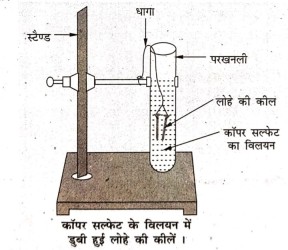 लोहे की तीन कीलें लिये जाते हैं। तब इन्हें रेगमाल से रगड़कर साफ कर दिया जाता है। दो परखनली (A) और (B) ली जाती है। इसमें 10 ml कॉपर सल्फेट का विलयन रखा जाता है। दोनों कीलों को धागे से बांध कर सावधानीपूर्वक परखनली B के कॉपर सल्फेट के विलयन में लगभग 20 मिनट रखने के बाद बाहर निकाला जाता है।
लोहे की तीन कीलें लिये जाते हैं। तब इन्हें रेगमाल से रगड़कर साफ कर दिया जाता है। दो परखनली (A) और (B) ली जाती है। इसमें 10 ml कॉपर सल्फेट का विलयन रखा जाता है। दोनों कीलों को धागे से बांध कर सावधानीपूर्वक परखनली B के कॉपर सल्फेट के विलयन में लगभग 20 मिनट रखने के बाद बाहर निकाला जाता है।
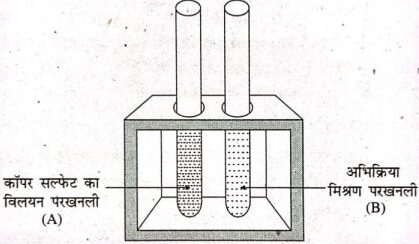
अब परखनली (A) और (B) में विलयन के नीले रंग की तुलना कीजिए पुनः कीलों की तुलना उस कील से कीजिए जो बाहर रखी हुई थी।आप पायेंगे कि कॉपर सल्फेट का विलयन का रंग नीला मलीन हो गया तथा लोहे के कील का रंग भूरा हो गया है।
Fe(s) + CuSO4 (aq.) → FeSO4 (aq.) + Cu(s)
इस अभिक्रिया में लोहे ने दूसरे तत्त्व कॉपर को कॉपर सल्फेट के विलयन से विस्थापित कर दिया है। लोहे के कील को भूरे रंग के होने का कारण है कि इसकी
सतह पर कॉपर की परत जमा हो गयी है। अतः विस्थापन अभिक्रिया को इस क्रियाकलाप द्वारा समझना आसान है।
6. निम्न पदों का वर्णन करें तथा प्रत्येक का एक-एक उदाहरण दें:
(a) संक्षारण (b) विकृतगंधिता।
अथवा, संक्षारण क्या है ? संक्षारण रोकने के उपाय बताइए।
उत्तर ⇒(a) संक्षारण – लोहे की बनी हुई वस्तुएँ चमकीली होती हैं लेकिन कुछ समय पश्चात् उन पर लालिमायुक्त भूरे रंग की परत चढ़ जाती है। आमतौर पर इस प्रक्रिया को लोहे पर जंग लगना कहते हैं । कुछ अन्य धातुओं में भी ऐसा ही परिवर्तन होता है। जब कोई धातु अपने आसपास अम्ल, नमी आदि के संपर्क में आती है तब ये संक्षारित होती हैं और इस प्रक्रिया को संक्षारण कहते हैं। चाँदी के ऊपर काली पर्त और ताँबे के ऊपर हरी पर्त चढ़ना, संक्षारण के उदाहरण हैं।
संक्षारण के कारण कार के ढांचे, पुल, जहाज तथा धातु विशेषकर लोहे से बनी वस्तुओं की बहुत क्षति होती है।
(b) विकृतगंधिता – वसायुक्त अथवा तैलीय खाद्य सामग्री जब लंबे समय तक रखा जाता है तब उसका स्वाद या गंध में परिवर्तन आ जाता है। उपचयित होने पर तेल और वसा विकृत गंधी हो जाते हैं तथा उनके स्वाद तथा गंध बदल जाते हैं । वायुरोधी बर्तनों में खाद्य सामग्री रखने से उपचयन की गति धीमी हो जाती है। क्या आप जानते हैं कि चिप्स बनाने वाले चिप्स की थैली को नाइट्रोजन जैसे गैस से युक्त कर देते हैं ताकि चिप्स का उपचयन न हो सके और उन्हें देर तक संरक्षित रखा जा सके।
7. वियोजन अभिक्रिया को संयोजन अभिक्रिया के विपरीत क्य कहा जाता है ? इन अभिक्रियाओं के लिए समीकरण लिखिए।
उत्तर ⇒ वे अभिक्रियाएँ जिनमें दो या अधिक पदार्थ संयुक्त होकर केवल एक पदार्थ बनाते हैं, संयोजन अभिक्रियाएँ कहलाती हैं तथा वे अभिक्रियाएँ जिनमें यौगिक दो अधिक सरल पदार्थों में टूटता है, वियोजन अभिक्रियाएँ कहलाती हैं। अतः वियोजन अभिक्रिया, संयोजन अभिक्रिया के बिल्कुल विपरीत है।
उदाहरण -:
(i) हाइड्रोजन, ऑक्सीजन में जलकर जल बनाती है।
![]()
जल में जब विधुत धारा प्रवाहित की जाती है, यह वियोजित होकर हाइड्रोजन गैसऔर ऑक्सीजन गैस देता है।
(ii) सोडियम धातु क्लोरिन में जलकर सोडियम क्लोराइड बनाता है।
गलित सोडियम क्लोराइड में जब विधुत धारा प्रवाहित की जाती है, यह वियोजित होकर सोडियम धातु और क्लोरीन गैस देता है ।

8. विस्थापन एवं द्विविस्थापन अभिक्रियाओं में क्या अंतर है ? इन अभिक्रियाओं के समीकरण लिखें।
उत्तर ⇒ विस्थापन अभिक्रिया – जब कोई एक तत्त्व दूसरे तत्त्व को उसके यौगिक से विस्थापित कर देता है तो वायु विस्थापन अभिक्रिया होती है।
उदाहरण -:
द्विविस्थापन अभिक्रिया – द्विविस्थापन अभिक्रिया में दो अलग-अलग परमाण या परमाणुओं के समूह (आयन) का आपस में आदान-प्रदान होता है।

उपरोक्त उदाहरण विस्थापन और द्विविस्थापन अभिक्रियाओं का अंतर स्पष्ट करते हैं।
9. रासायनिक अभिक्रियाओं के प्रकार उदाहरण सहित लिखें।
उत्तर ⇒रासायनिक अभिक्रिया के दौरान किसी एक तत्त्व का परमाणु दूसरे तत्त्व के परमाणु में नहीं बदलता है। न ही कोई परमाणु मिश्रण से बाहर जाता है या बाहर से मिश्रण में आता है। वास्तव में, किसी रासायनिक अभिक्रिया में परमाणुओं के आपसी आबंध के टूटने और जुड़ने से नए पदार्थों का निर्माण होता है।
(a) संयुक्त आभाक्रया – ऐसी अभिक्रिया जिसमें दो या दो से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते हैं उसे संयुक्त अभिक्रिया कहते हैं ।
जैसे – कैल्सियम ऑक्साइड जल के साथ तीव्रता से अभिक्रिया करके बुझे हुए चूने (कैल्सियम हाइड्रोक्साइड) का निर्माण करके अत्यधिक मात्रा में ऊष्मा उत्पन्न करता है।
जैसे- CaO(s) + H2O (l) → + Ca(OH)2(aq)
(बिना बुझा हुआ चूना) (बिना बुझा हुआ चूना)
इस अभिक्रिया में कैल्सियम ऑक्साइड तथा जल मिलकर एकल उत्पाद, कैल्सियम हाइड्रोक्साइड बनाते हैं।
(b) वियोजन अभिक्रिया – वह अभिक्रिया जिसमें एकल अभिकर्मक टूटकर छोटे-छोटे उत्पाद प्रदान करता है।
वियोजन अभिक्रिया के उदाहरण –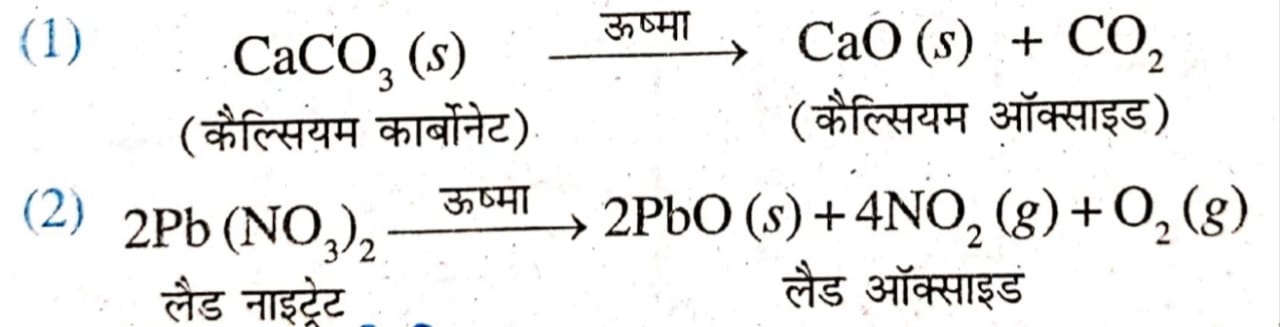
विस्थापन अभिक्रिया – जब कोई तत्त्व दुसरे तत्त्व को उसके यौगिक से विस्थापित कर देता है तो वह विस्थापन अभिक्रिया होती है।
उदाहरण-

(d) द्विविस्थापन अभिक्रिया – द्विविस्थापन अभिक्रिया में दो अलग-अलग परमाणु या परमाणुओं के समूह का आपस में आदान-प्रदान होता है।
उदाहरण-: 