1. अम्ल और क्षारक में अंतर बतावें।
उत्तर⇒
| अम्ल | क्षारक |
| (i) इसका स्वाद खट्टा होता है। | (i) इसका स्वाद खारा होता है। |
| (ii) यह नीले लिटमस पत्र को लाल करता है। | (ii) यह लाल लिटमस पत्र को नीला करता है। |
| (ii) यह मेथिल ऑरेंज को लाल कर देता है। | (iii).यह मेथिल ऑरेंज को पीला कर देता है। |
| (iv) यह जल में विलेय होकर हाइड्रोजन आयन (H+)देता है। | (iv) यह जल में विलेय होकर हाइड्रॉक्साइड (OH) आयन देता है। |
| (v) यह क्षारक को उदासीन कर देता है। | (v) यह अम्ल को उदासीन कर देता है। |
| (vi) इसका pH मान 7 से कम होता है। | (vi) इसका pH मान 7 से अधिक होता है। |
2. साधारण नमक का उत्पादन कैसे होता है ? इसे रासायनिक उद्योग का कच्चा माल क्यों कहते हैं ?
उत्तर⇒ हाइड्रोक्लोरिक अम्ल और सोडियम हाइड्रॉक्साइड के विलयन आपस | में अभिक्रिया कर सोडियम क्लोराइड नमक बनाता है।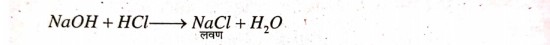
यह लवण उदासीन है।
समुद्री जल में कई प्रकार के लवण घुले होते हैं। इन लवणों से सोडियम क्लोराइड प्राप्त किया जाता है।
इस प्रकार प्राप्त साधारण नमक हमारे दैनिक उपयोग के कई पदार्थों, जैसे सोडियम हाइड्रॉक्साइड, बेकिंग सोडा, वाशिंग सोडा, विरंजक चूर्ण आदि के लिए | यह एक महत्त्वपूर्ण कच्चा पदार्थ है।
3. धोनेवाले सोडा का निर्माण कैसे किया जाता है ? इसके तीन उपयोगों को लिखें।
उत्तर⇒ बेकिंग सोडा को गर्म करने पर सोडियम कार्बोनेट (धोने वाला सोडा) का निर्माण होता है।
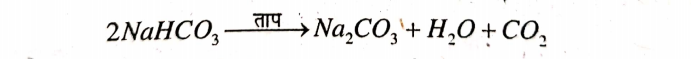
सोडियम कार्बोनेट में क्रिस्टलन जल के 10 अणु होते हैं। अतः इनके क्रिस्टल का अणुसूत्र Na2CO3 10H2O है।
धोनेवाले सोडा के तीन उपयोग :
(i) सोडियम कार्बोनेट का उपयोग काँच, साबुन एवं कागज उद्योगों में होता है।
(ii) जल की स्थायी कठोरता दूर करने में भी इसका उपयोग होता है
(iii) बोरेक्स जैसे सोडियम यौगिक के बनाने में इसका उपयोग है।
4. वाशिंग सोडा अथवा सोडियम कार्बोनेट का उत्पादन कैसे किया जाता है ? संक्षेप में अभिक्रिया समेत लिखें। इसके उपयोग भी लिखें।
उत्तर⇒ सोडियम कार्बोनेट का उत्पादन साल्वे विधि से किया जाता है। इस विधि में सोडियम क्लोराइड के संतप्त घोल को अमोनिया से संतृप्त कर उसमें कार्बन डायऑक्साइड गैस प्रवाहित किया जाता है। इससे सोडियम हाइड्रोजन कार्बोनेट का अवक्षेप प्राप्त होता है।
NH3 + H2O + CO2 → NH4HCO3
NaCl + NH4HCO3 → NaHCO3 ↓+ NH4Cl2
अवक्षेप को छानकर सुखा लिया जाता है। इसे गर्म करने पर सोडियम कार्बोनेट प्राप्त होता है। फिर इसका रवाकरण कर वाशिंग सोडा प्राप्त किया जाता है।
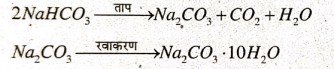
अमोनिया और सोडा वाटर (Co, का जलीय घोल) को कच्चे माल के रूप में प्रयोग में लाने के कारण इस विधि को अमोनिया-सोडा विधि कहा जाता है।
इसका उपयोग :
(i) कपड़ा धोने में
(ii) जल की अस्थायी कठोरता दूर करने में
(iii) अभिकर्मक के रूप में।
5. प्लास्टर ऑफ पेरिस के निर्माण की विधि एवं उपयोग लिखें।
उत्तर⇒ जिप्सम को 373°K पर गर्म करने पर यह जल के अणओं का त्याग कर कैल्सियम सल्फेट अर्द्धहाइड्रेट 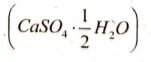 बनाता है।
बनाता है।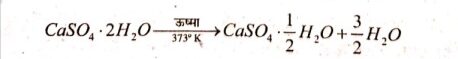
इसका उपयोग :
(i) डॉक्टर टूटी हड्डियों को सही जगह पर स्थिर रखने के लिए इसकाउपयोग करते हैं।
(ii) इसका उपयोग खिलौना बनाने में होता है।
6. जलीय विलयन में अम्ल और क्षारक का क्या व्यवहार होता है ?
उत्तर⇒ जल की उपस्थिति में HCl में हाइड्रोजन आयन (H+) उत्पन्न होते हैं। जल की अनुपस्थिति में HCl अणुओं से H+ आयन पृथक नहीं हो सकते हैं।
HCl+ H2O → H3O++Cl–
हाइड्रोजन आयन स्वतंत्र रूप में नहीं रह सकते लेकिन ये जल के अणुओं के साथ मिलकर रह सकते हैं। अतः हाइड्रोजन आयन को सदैव H+ (aq.) या हाइड्रोनियम आयन (H3O+) से दर्शाया जाता है। यह विद्युत का चालन करता है। किसी क्षारक को जल में घोलने पर हाइड्रोक्सिल आयन (OH–) उत्पन्न होते हैं।
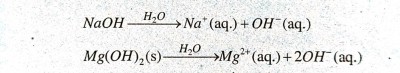
जल में घुलनशील क्षारक को क्षार कहते हैं।
7. उत्फुलनशील, प्रस्वेदी और द्रव्याग्राही लवण से,क्या समझते हैं ? समझाकर लिखें।
उत्तर⇒ उत्कुलन लवण : कुछ रवायुक्त लवण को वायु में छोड़ देने पर अपना रवाजल को खोकर चूर्ण के समान लवण बच जाते हैं। ऐसे लवण उत्फुल लवण कहे जाते हैं।
जैसे Na2Co3 10H2O, Na2so4 10H2O आदि।
प्रस्वेदी लवण : कुछ लवण हवा में छोड़ देने पर नमी सोख कर पसीज जाते हैं और धीरे-धीरे एक जलीय घोल के रूप में परिणत हो जाते हैं। ऐसे लवण प्रस्वेदी कहलाते हैं। जैसे कैल्सियम क्लोराइड, जिंक क्लोराइड आदि।
द्रव्यग्राही लवण – कुछ रवादार लवण वायु से जल को सोख लेते हैं लेकिन इतना नहीं सोखते हैं कि वे गीले हो जाएँ।
ऐसे लवण द्रव्यग्राही लवण कहलाते हैं जैसे नमक में अशुद्धि के रूप में थोडा मैगनीसियम क्लोराइड होता है जिससे यह पसीज जाता है।
8. अल्कोहल एवं ग्लूकोज जैसे यौगिकों में भी हाइड्रोजन होते हैं लेकिन इनका वर्गीकरण अम्ल की तरह नहीं होता है। एक क्रियाकलाप द्वारा इसे साबित कीजिए।
उत्तर⇒ क्रियाकलाप – एक बीकर लिया जाता है। इसके बीचों-बीच एक रबर का कॉर्क रखकर इसमें दो कील ठोक दिया जाता है। दोनों कीलों को 6 वोल्ट की बैट्री से जोड़ा जाता है। परिपथ में एक बल्ब और स्वीच भी लगा दिया जाता है। बीकर में अल्कोहल का विलयन लिया जाता है। विधुत-धारा प्रवाहित की जाती है। बल्ब नहीं जलता है। अगर अल्कोहल विलयन की जगह ग्लूकोज विलयन लेकर प्रयोग को दुहराया जाता है तो भी बल्ब नहीं जलता है। इस प्रयोग से यह निष्कर्ष निकलता है कि विलयन से कोई विधुत-धारा नहीं बहती है।
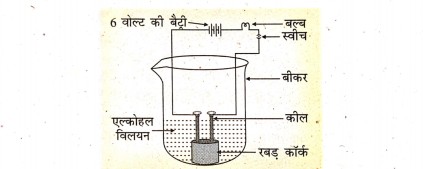
अगर इन विलयनों की जगह हाइड्रोक्लोरिक अम्ल लेकर विद्युत-धारा प्रवाहित की जाती है तो बल्ब जल उठता है। हाइड्रोक्लोरिक अम्ल से हाइड्रोजन आयन (H’) उत्पन्न होते हैं। विलयन में विद्युत-धारा का प्रवाह आयनों द्वारा होता है। इससे यह स्पष्ट होता है कि विद्युत-धारा प्रवाहित करने पर ग्लूकोज विलयन एवं अल्कोहल विलयन पर (H’) आयन नहीं देते हैं। H+ आयन देने वाले विलयन ही अम्लीय होता है। ग्लूकोज और अल्कोहल में हाइड्रोजन है, लेकिन विलयन आयन नहीं उत्पन्न करते हैं। ___ यही कारण है कि ग्लूकोज और अल्कोहल को अम्ल की श्रेणी में वर्गीकृत नहीं किया गया है।
9. क्षारकों/क्षारों के रासायनिक गुण संक्षेप में लिखिए।
उत्तर⇒ क्षारकों/क्षारों के महत्त्वपूर्ण रासायनिक गुण निम्न हैं
(a) धातुओं से क्रिया—–क्षार कुछ धातुओं से क्रिया कर H गैस उत्पन्न करते हैं।
Zn + 2NaOH → Na2O + H 2 (g)
सोडियम जकेट
2AI+ 2NaH+ 2H2O → 2NaAlO2+3H
सोडियम अलुमिनेट
(b) वायु से क्रिया- कुछ क्षार वायु में उपस्थित CO2 से क्रिया करते हैं।
2NaOH + CO2 → Na2CO3
2KOH + CO2 → K2CO3
(c) अम्लों से क्रिया – क्षारक/क्षार अम्लों से क्रिया कर लवण तैयार करते हैं।
NaOH + HCl → NaCl + H2o
Fe (OH)2+2HCl → FeCl2 + 2H2O
Ca (OH)2+2HCl → CeCl2 + 2H2O
(d) लवणों से क्रिया – तांबा, लोहा, जिंक आदि के लवण क्षारों/क्षारकों से क्रिया करते हैं और अघुलनशील धात्विक हाइड्रॉक्साइड तैयार करते हैं।
ZnSO4 + 2NaOH → Na2SO4 + Zn (OH)2 ↓
CuSO4+2NH4OH → (NH4)2SO4 + Cu (OH)2 ↓
FeCl3 + 3NaOH → 3NaCl + Fe (OH)3 ↓
10.अम्ल की तरह नहीं होता है । एक क्रियाकलाप के द्वारा साबित कीजिए।
उत्तर⇒ यद्यपि ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिकों में हाइड्रोजन होती है पर वे विलयन में आयनीकृत नहीं होते और H+ आयन उत्पन्न नहीं करते यह इस तथ्य से साबित होता है कि उनके विलयन विद्युत् चालन नहीं करते ।
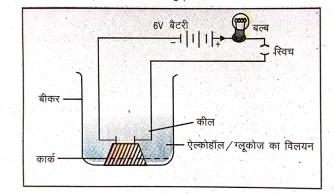
क्रिया – कलाप – एक बीकर में ऐल्कोहॉल, ग्लूकोज आदि का विलयन लीजिए। एक कार्क पर दो कील लगाकर कॉर्क को बीकर में रख दीजिए । कीलों को 6 वोल्ट की एक बैटरी के दोनों टर्मिनलों के साथ एक बल्ब और स्विच के माध्यम से जोड़ दीजिए। अब विद्युत् धारा प्रवाहित कीजिए । विद्युत् चालन नहीं हुआ।
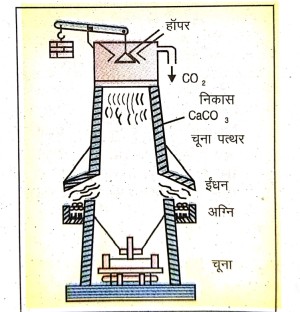
11. चूना कैसे बनाया जाता है ?
उत्तर⇒ कैल्सियम ऑक्साइड (CaO) ही चूना है जो कि चूने के पत्थर (CaCO3) को गर्म करके बनाया जाता है –

चुने का पत्थर (CaCo3) चूने की भट्टी के ऊपर से डाला जाता है। भट्टी के बीच में उपस्थित अग्नि बक्सों में कोयला जलाकर भट्टी को गर्म किया जाता है। गर्म होने पर चूने के पत्थर का अपघटन होता है और कार्बन डाइऑक्साइड गैस अन्य गर्म गैसों के साथ ऊपर की ओर बाहर निकल जाती है तथा कैल्सियम ऑक्साइड (चूना) भट्टी के फर्श से एकत्रित कर लिया जाता है।
12. दैनिक जीवन में pH का महत्त्व स्पष्ट कीजिए।
उत्तर⇒ pH का हमारे दैनिक जीवन में बहुत अधिक महत्त्व है –
(i) मानव और जंतु जगत में – हमारे शरीर की अधिकांश क्रियाएँ 7.0 से 7.8 pH परास के बीच काम करती हैं। हम इसी संकीर्ण परास में ही जीवित रह सकते हैं। हमारे रक्त, आँसुओं, लार आदि का pH लगभग 7.4 होता है। यदि यह 7.0 से कम हो जाता है या 7.8 से बढ़ जाता है तो जीवन असंभव-सा हो जाता है। वर्षा के जल से pH का मान जब 7 से कम होकर 5.6 हो जाता है तो उसे अम्लीय वर्षा कहते हैं । अम्लीय वर्षा का जल जब नदियों में बहता है तो नदी के जल का pH मान कम हो जाता है जिस कारण जलीय जीवधारियों का जीवन कठिन हो जाता है।
.
(ii) पेड़-पौधों के लिए पेड – पौधों की अच्छी वृद्धि और अच्छी उपज के लिए मिट्टी के pH परास की विशेषता बनी रहनी चाहिए । यदि यह अधिक अम्लीय या क्षारीय हो जाए तो उपज पर कुप्रभाव पड़ता है।
(iii) पाचन तंत्र – हमारे पेट में HCl उत्पन्न होता रहता है जो हमें बिना हानि पहुँचाए भोजन के पाचन में सहायक होता है । अपच की स्थिति में इसमें अम्ल की मात्रा अधिक बनने लगती है जिस कारण पेट में दर्द और जलन अनुभव होता है। इस दर्द से छुटकारा पाने के लिए ऐंटैसिड जैसे क्षारकों का प्रयोग करना पड़ता है। इसके लिए प्रायः मिल्क ऑफ मैग्नीशियम जैसे दुर्बल क्षारक का प्रयोग करना आवश्यक हो जाता है।
(iv) दंत-क्षय – हमारे मुँह के pH मान 5.5 से कम होने पर का क्षय शुरू हो जाता है। हमारे दाँत कैल्सियम फॉस्फेट से बने होते हैं जो शरीर का सबसे कठोर पदार्थ है। यह जल में नहीं घुलता पर मुँह की pH मान 5.5 से कम होने पर यह नष्ट होने लगता है। मुँह में उपस्थित जीवाणु, अवशिष्ट शर्करा और खाद्य पदार्थों के निम्नीकरण से अम्ल उत्पन्न होते हैं। इनसे छुटकारा पाने के लिए क्षारकीय दंत-मंजन का प्रयोग किया जाना चाहिए । इससे अम्ल की अधिकता उदासीन हो जाती है और दाँत क्षय से रोके जा सकते हैं।
(v) जीव-जंतुओं के डंक से रक्षा – जब जीव जंतु कभी डंक मार देते हैं तो वे हमारे शरीर में विशेष प्रकार के अम्ल छोड़ देते हैं। मधुमक्खी भिरंड, चींटी आदि मेथेनॉइक अम्ल हमारे शरीर में डंक के माध्यम से पहुंचा देते हैं। इससे उत्पन्न पीड़ा से मुक्ति के लिए डंक मारे गए अंग पर बेकिंग सोडा जैसे दुर्बल क्षारक का प्रयोग करना चाहिए।
(VI) विशष पाधों से रक्षा – नेटल (Nettle) पौधे के पत्तों पर डंकनमा बाल . हात है । उन्हें छू जाने से डंक जैसा दर्द होता है। इन बातों से मेथैनॉइक अम्ल का स्राव हाता है जो दर्द का कारण बनता है। पारंपरिक तौर पर इस पीडा मुक्ति डॉक पौधे की पत्तियों को डंक वाले स्थान पर रगडकर पाई जाती है।